知道这个激素超标难孕,万万想不到对子代影响更大,听劝早干预
之前聊到了多囊卵巢综合征,我们提到了雄激素,根据袁莹莹等提供的数据,在多囊姐妹中,88%具有较高的雄激素水平。
我们都知道,雄激素会造成卵子质量下降,影响怀孕成功率,另外也会影响妊娠进程。
比如造成妊娠糖尿病概率增高,国外文献发现,高雄是妊娠糖尿病最强预测因素,同时也是子痫前期的风险因素。

你以为雄激素的影响仅限于此吗,它对子代的影响是最容易被忽视的,但却是危害最大的,赶紧跟着E好孕一起来看看吧!
01、子代患多囊几率是普通女性的5倍
这个结论不是我说的,而是来自于NATURE子刊《自然-医学》,这是一个基于人口学调查和动物研究相结合的文献。

瑞典斯德哥尔摩的卡罗林斯卡学院分析了瑞典多囊卵巢综合征女性患者的医疗记录,并对一项病例对照研究中的智利多囊卵巢综合征女性患者及其女儿的数据进行了追踪。
作者发现,瑞典和智利的多囊卵巢综合征女性患者其女儿被诊断出该疾病的几率是普通女性的五倍。
为了验证这个数据,研究者进行了小鼠研究,妊娠晚期注射双氢睾酮诱导雌性小鼠(F0)具有多囊卵巢综合症样特征,根据孕期肥胖与否进行分组。
这些小鼠产生了具有多囊卵巢综合征样生殖和代谢表型的雌性F1-F3后代。
来自F1-F3后代的中期II卵母细胞的测序显示,所有世代的基因表达都发生了共同和独特的改变。
值得注意的是,在病例对照研究中,四个基因在女儿的数据中也有表达。
这个发现提供了多囊卵巢综合症母亲女性后代的跨代效应的证据,并确定了预测后代多囊卵巢综合症表型的可能候选基因。
研究者进一步分析发现,产前的雄性激素暴露,而非孕期肥胖,才是产生这种跨代效应的原因,且这些效应会持续发挥作用,最多能遗传三代。
母体和胎儿之间通过胎盘进行营养物质交换和代谢作用,但是胎盘虽能阻止某些有害物质进入胎儿血中,但是这种屏障作用极其有限。
同时胎盘也具备雌激素、孕激素和雄激素的合成功能,母体雄激素加上胎盘自身产生的雄激素,会对胎儿产生过量的影响,干扰子代性激素负反馈作用,导致先天的生殖系统异常。
02、影响子代心血管健康
宫内高雄激素环境可以降低胎儿心脏成熟度,引起子代成年期心肌肥大和纤维化。
在一项针对母羊的研究中,在妊娠早期(30——59天)和中晚期(60——90天)给予母羊睾酮处理。

取近足月胎羊心脏分析发现,早期睾酮处理组胎羊心脏质量降低,心肌细胞成熟减少,增殖降低,心肌细胞大小变化无差异,而晚期睾酮处理对心肌细胞生长发育影响不明显。
进一步分析发现,早期睾酮处理组血清循环胰岛素样生长因子-1含量降低,可能和心肌细胞增殖降低相关。
另外,无论治疗如何,雄性胎儿的成熟心肌细胞都比雌性胎儿少。
宫内高雄激素环境不仅可以对心脏产生影响,同时损伤血管,造成子代成年期血压升高,增加成年期发生高血压的风险。
有研究使用妊娠大鼠在孕15——19 天皮下注射丙酸睾酮模拟宫内高雄激素环境,结果发现宫内高雄激素暴露大鼠的雌性后代成年期血压升高。

和对照组相比,实验组内皮完整的肠系膜动脉对苯甲肾上腺素的收缩反应增强,对乙酰胆碱的舒张反应减弱,对硝普钠的反应不变。
宫内过高雄激素暴露造成内皮细胞功能障碍可能是通过降低内皮细胞一氧化氮合酶表达,减少一氧化氮生成所介导的。
以上动物实验证据表明,宫内高雄激素暴露可以造成成年雌性后代心肌肥厚,成年期血压升高,但是其机制尚未明确。
除了和遗传、饮食、环境等因素相关外,“健康与疾病的发育起源”学说将代谢性疾病的病因学探讨指向了孕期宫内环境。
我国作者的一篇顶刊文献招募了患有多囊卵巢综合症的孕妇(n = 12)和没有多囊卵巢综合症的孕妇(n = 11)。

然后,在分娩后采集胎盘、母体血液和脐带血,进行分析研究。
结果发现,多囊患者所产新生儿脐血中硫酸脱氢表雄酮、雄烯二酮、瘦素、高密度脂蛋白和胆固醇的含量明显高于对照组。
与对照组相比,多囊卵巢综合症组的胎盘显示出更多的梗死、钙化现象。
这说明过度暴露于雄激素会影响胎盘的功能,这与新生儿代谢紊乱的发展有关。
除了新生儿雄激素增高,胰岛素抵抗也呈现了受影响的趋势,即所谓的遗传效应。

在母羊孕30——90 天每周2次给予丙酸睾酮处理以模拟宫内高雄激素环境的研究发现,雌性胎儿胰腺和胎儿体重比值下降,胰岛α细胞数量降低,β细胞呈现凋亡增加趋势。
成年雌性子代则表现为胰岛β细胞体积增大,β细胞比例有增加的趋势,胰岛胶原纤维增加,提示伴随慢性胰岛素抵抗的胰岛β细胞衰竭即将到来。
以上都是雌性子代研究,对雄性子代研究比较少。
2016年的一个研究发现,宫内高雄激素环境可以引起雄性子代胰岛素敏感性降低、糖耐量异常,胰岛数量、大小、β细胞面积减小。
总之,宫内高雄激素环境与子代糖脂代谢紊乱,胰岛素敏感性降低以及胰岛素抵抗密切相关,但机制尚不明确,仍需要更多的实验研究阐明机制。
04、导致子代大脑发育异常
人群队列及动物研究表明,宫内高雄激素环境影响胎儿脑发育,且与子代出现孤独症、注意缺陷多动障碍、广泛性发育障碍及焦虑、抑郁等认知行为改变以及情感障碍相关。
动物研究发现,使用芳香化酶抑制剂创造的宫内高雄激素环境可导致子代青春期焦虑、抑郁样行为。

青春期大鼠海马齿状回中表达的成熟神经元明显减少。
这表明怀孕期间接触雄激素会导致抑郁、焦虑和刻板印象行为的改变,雄激素受体信号激活在宫内高雄激素暴露造成子代焦虑行为发生中起重要的作用。
05、增加男性子代糖尿病风险
以上大部分是针对女性子代,对男性子代的影响似乎比女性要小,但是陈子江院士领衔的这项研究发现了对男性子代影响最大的可能就是糖尿病风险。
2025年2月12日,山东大学妇儿与生殖健康研究院赵涵教授、陈子江院士、张玉青副研究员等在 Cell Discovery 期刊发表了相关论文。

该研究发现,母体的雄激素暴露通过改变雄性后代精子的 DNA 甲基化模式,导致胰腺β细胞功能障碍,进而增加糖尿病的发病风险,且这种风险能够在雄性后代中跨代遗传。
在这项新研究中,研究团队使用了山东大学生殖医学中心的大规模母婴队列。
该队列分析了 561 名患有高雄激素血症(女性血液中的雄激素水平异常升高)的母亲所生的儿子和 1122 名雄激素水平正常母亲的儿子的代谢参数。
结果显示,患有高雄激素血症的母亲所生的儿子在儿童期表现出 β 细胞功能异常。
为了验证结果的普适性,研究者们又进行了动物试验验证,F0 代母鼠在孕期接受二氢睾酮注射,模拟母体雄激素暴露,随后观察 F1-F4 代雄性小鼠的代谢表型。
结果发现,F1 代雄性小鼠在 8 周龄时表现出血糖水平降低和葡萄糖耐量增强,但 F2 代小鼠则出现高血糖和葡萄糖不耐受,且这种表型在 F3 代中持续存在。
随着年龄增长,F1-F3 代雄性小鼠的高血糖和葡萄糖不耐受现象逐渐加重,高脂饮食进一步加剧了这些代谢紊乱。
但是,即便在高脂饮食下,F4代雄性小鼠没有再观察到血糖水平和葡萄糖不耐受。
研究团队还发现,F1 代雄性小鼠精子中与胰岛素分泌相关的基因发生了 DNA 甲基化改变,并且这些甲基化改变在 F2 代小鼠的胰岛中得以保留,导致这些基因的表达继续下调。
总的来说,这项研究揭示了母体的雄激素暴露对雄性后代的代谢健康的跨代影响,强调了孕期激素环境对后代长期健康的重要性。
06、如何进行干预减轻对子代影响
在陈子江院士团队研究中发现,热量限制和二甲双胍治疗可以逆转 F1 代雄性小鼠的高血糖和葡萄糖不耐受,并阻止这些代谢紊乱向 F2 代的传递。
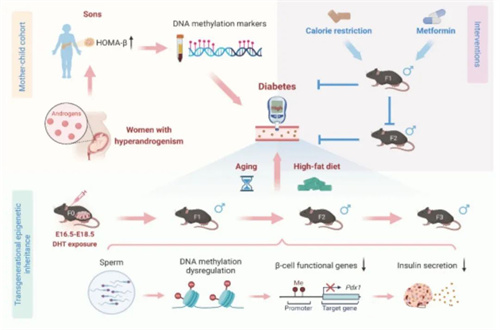
热量限制是通过从16周大开始喂养80%的正常摄入量来执行的,当F1雄性已经出现了葡萄糖不耐受时,另一组F1小鼠以每天250毫克/千克的二甲双胍剂量治疗了四周。
这些干预措施通过恢复精子中异常的 DNA 甲基化模式,改善了β细胞功能基因的表达。
另外还有研究发现,多囊模型大鼠补充肌醇可以显著降低胰岛素抵抗指数,缓解胰岛素抵抗,降低血清LH、LH/FSH、睾酮含量,并且升高雌二醇水平。
多囊女性补充小剂量补充维生素D可以降低血清甘油三酯的含量,但是对胰岛素抵抗指数、低密度脂蛋白、游离睾酮和总睾酮量无明显改善作用。
肉桂粉可以显著降低多囊女性空腹胰岛素水平,改善胰岛素抵抗,同时降低低密度脂蛋白水平。
此外,对于多囊姐妹来说,减重和改善胰岛素抵抗也是降低雄激素的重要手段,因为肥胖妈妈的高胰岛素血症会升高血里的游离雄激素水平。
这样的妈妈即便能够成功怀孕,血里和胎盘里的雄激素水平是明显升高的,这对宝宝也是不安全的。
但是这对于宫内高雄激素暴露下造成子代内分泌代谢的不良影响是否存在治疗作用仍不明确。

另外,这些治疗方法用于孕期的安全性、有效性等需要更多的试验加以证实。
总之,对于多囊卵巢综合征来说备孕是非常关键的,并不是直接上来就促排或者试管就可以的,进行生活方式的调整和治疗,降低体内的雄激素水平对自己和宝宝都是最佳的。
别忘了,雄激素水平高除了给子代长期带来不良影响外,还会影响母亲妊娠安全,妊娠糖尿病、子痫前期,无论遇到哪一个都威胁母婴安全。
所以多囊姐妹,请一定做好准备再去怀孕,母婴健康才是优生的关键!





